Qual é o melhor teste para o diagnóstico da leishmaniose canina?
Um breve histórico de uma doença negligenciada que ultrapassou barreiras socioeconômicas e os frágeis recursos que temos atualmente para as tentativas de prevenção e controle


O que é leishmaniose?
A leishmaniose é uma zoonose vetorial, ou seja, é uma doença que pode ser transmitida dos animais para o homem por meio de vetores. É causada por parasitas protozoários do gênero Leishmania e a transmissão ocorre pela picada das fêmeas infectadas de mosquitos hematófagos dos gêneros Phlebotomus e Lutzomyia, da subfamília dos flebotomíneos. Nas Américas, apenas os mosquitos do gênero Lutzomyia fazem parte do ciclo de transmissão e são popularmente conhecidos como mosquitos-palha. O gênero Phlebotomus está associado à ocorrência da doença nos países da Europa, Ásia e África.
Diferentemente do Aedes aegypti e do Aedes albopictus (vetores da dengue, zika, chikungunya e febre amarela), os mosquitos transmissores da leishmaniose não dependem de água parada para a oviposição, mas sim de matéria orgânica em decomposição para completarem seus ciclos reprodutivos. Existem mais de 500 espécies de flebotomíneos, mas apenas, aproximadamente, 30 são conhecidas por serem capazes de transmitir a leishmaniose.
Segundo a Organização Mundial de Saúde (WHO, 2024), existem mais de 20 espécies de Leishmania e três formas da doença nos humanos: a leishmaniose visceral (calazar), que é sistêmica e causa febre, anemia, fraqueza e aumento do fígado e do baço, a leishmaniose tegumentar (úlcera de Bauru ou ferida brava), que causa úlceras focais na pele, e a leishmaniose muco-cutânea, que, além das úlceras na pele, causa também lesões nas mucosas das vias respiratórias, que são de difícil cicatrização e bastante debilitantes. Há tratamento, porém o sucesso depende do estado nutricional, da saúde renal e da imunidade do indivíduo.
A espécie L. tropica ocorre em áreas urbanas do Oriente Médio, causando a forma tegumentar, enquanto L. donovani está relacionada ao norte da Índia, Nepal, Bangladesh e leste da África, principalmente, Etiópia e Sudão, e está associada à forma visceral. Nas Américas, várias espécies são causadoras da forma tegumentar. A L. infantum (= L. chagasi) é a responsável pela forma visceral e, mais raramente, pela muco-cutânea, que são as mais preocupantes.
Apesar de existirem zonas com altos índices de subnutrição humana, onde a leishmaniose é mantida na população pelos próprios humanos infectados (antroponose), o principal reservatório da doença é o cachorro doméstico. Portanto, são esses animais que mantêm a infecção circulando na maioria das regiões afetadas, servindo como fonte de formas amastigotas da Leishmania para a transformação na forma infectante (promastigotas) no organismo do mosquito-palha. Dessa maneira, a doença é transmitida para outros cães e para o homem. É por esse motivo que qualquer estratégia de controle da leishmaniose zoonótica deve ter os cães e os vetores como alvos nos principais componentes.
Nos cães, a infecção é chamada leishmaniose canina e é mais comumente associada à espécie L. infantum (= L. chagasi), que se manifesta de uma forma víscero-cutânea. Outras espécies também podem acometer os cães no Novo Mundo, como L. amazonensis, L. braziliensis, L. mexicana e L. venezuelensis. As espécies L. tropica e L. major ocorrem na Europa, Ásia e África e estão raramente associadas à forma cutânea em cães. Por ser uma doença que depende das condições nutricionais e imunológicas para a manifestação de sinais, muitos cães permanecem assintomáticos, o que torna a identificação difícil e contribui para a manutenção da infecção em áreas endêmicas. Com o aumento da população de cães infectados, evidentemente, amplia-se as zonas de ocorrência da doença.
O surgimento de espécies emergentes de Leishmania é uma preocupação, principalmente, devido às mudanças climáticas e alterações na dinâmica populacional dos mosquitos hematófagos. O aumento das temperaturas pode reduzir o tempo de desenvolvimento das larvas e afetar o período de incubação dos protozoários, o que se reflete na maior duração da infectividade dos vetores. Esse cenário requer atenção ainda maior nos países de clima temperado, pois invernos mais quentes podem não ser suficientes para quebrar o ciclo de infecção dos mosquitos, aumentando a incidência da doença nesses locais a longo prazo.
Uma doença negligenciada que ultrapassou barreiras socioeconômicas
Por muitos anos, a leishmaniose em humanos foi considerada uma doença associada a ambientes de baixo desenvolvimento socioeconômico no Brasil. Regiões pobres, sem saneamento básico e onde é comum o acúmulo intenso de lixo e matéria orgânica em decomposição eram os locais mais favoráveis para a proliferação dos mosquitos transmissores.
A questão é que um programa oficial de controle eficaz da leishmaniose canina nunca foi de fato implementado no Brasil. Passados mais de 30 anos que se estuda mais afundo a dinâmica da doença, a realidade atual é a de que a infecção se encontra disseminada em todo o território nacional, inclusive em bairros nobres, onde há saneamento básico, educação e acesso às redes pública e privada de saúde.
A preocupação com a indução de resistência a antimicrobianos fez com que os órgãos de saúde pública proibissem o tratamento em cães com princípios ativos usados em humanos, como antimoniato de meglumina (Glucantime), anfotericina B, alopurinol e pentamidina. A lentidão para o desenvolvimento de uma medicação específica para cães (registrada apenas em 2018), associada à orientação para a eliminação de cães com diagnóstico positivo confirmado, criou na população o hábito de esconder animais infectados para que não fossem eutanasiados, visto que uma porção considerável da população considera seus cães como membros da família. Além disso, muitos animais, provavelmente, foram tratados com os princípios proibidos. Tudo isso, infelizmente, contribuiu para a disseminação da doença e expôs a saúde pública ao risco de desenvolvimento de resistência aos princípios ativos usados no tratamento de humanos.
Vale lembrar que a leishmaniose canina é uma doença de notificação obrigatória, conforme disposto na Instrução Normativa MAPA n° 50, de 23 de setembro de 2013. Portanto, todos os casos confirmados devem ser reportados mensalmente ao serviço veterinário oficial para consolidação, conhecimento da situação epidemiológica e envio semestral à Organização Mundial de Saúde Animal. Entretanto, em geral, nem veterinários do setor privado nem os órgãos de saúde pública cumprem essa determinação, sendo, portanto, a doença subnotificada. Por esse motivo, desde 2006, a situação da leishmaniose canina no Brasil, disponível no World Animal Health System (WAHIS, 2024), é de presente em todo o território nacional sem dados quantitativos.
No momento, sem vacinas...
Outro fator importante para o fracasso no controle da leishmaniose canina no Brasil está relacionado ao histórico conturbado na evolução das vacinas. No período de 2003 a 2014, foi comercializada a Leishmune® (Zoetis), com proteção individual de 80% e estudos que indicaram bons resultados para imunoterapia em cães doentes. Esta vacina foi suspensa após os resultados da fase III (última fase), que demonstraram ineficácia em estudo clínico. Ou seja, a Leishmune foi comercializada, no Brasil, durante 11 anos até que se verificou clinicamente que o imunizante não era capaz de prevenir a infecção de cães em nível populacional.
A partir de 2008, passou-se a comercializar a Leish-Tec® (Ceva), que apresentava, segundo o fabricante, proteção individual de 96,41% e 71,3% de eficácia, mas que apresentou apenas 43% de proteção em um estudo in vitro. Em 2023, essa vacina foi suspensa após ações de fiscalização, pelo Ministério da Agricultura e Pecuária (Mapa), que identificaram uma degradação de antígeno e, consequentemente, um teor de proteína A2 inferior ao limite mínimo estabelecido na licença, o que pode comprometer sua eficácia. Há 1 ano, aguarda-se a correção dessa inconformidade para a disponibilização do imunizante, que não faz parte do Sistema Único de Saúde.
Na Europa, também foram disponibilizadas duas vacinas contra diferentes espécies de Leishmania. De qualquer forma, a eficácia de todas as vacinas já desenvolvidas para cães até o momento é contestada e ainda gera muita discussão entre profissionais de saúde. A Organização Mundial de Saúde Animal (WOAH, 2021) não reconhece a eficácia dessas vacinas e destaca que seu uso pode representar um desafio para a vigilância da leishmaniose canina, uma vez que também não há o reconhecimento de que algum teste possa ser utilizado para diferenciar animais infectados dos vacinados. Isso é particularmente preocupante nos países onde a doença não está presente e ações de controle poderiam ser tardias após introdução e disseminação silenciosas (sem identificação). Por isso, é mais fácil comprovar que um país ou região são livres de uma doença animal quando não há vacinação.
O Brasil, porém, encontra-se em uma situação totalmente diferente. A ampla disseminação e instalação da doença a caracterizam como endêmica, ou seja, provavelmente jamais será erradicada e ações mais eficazes de prevenção e controle são necessárias em nível populacional, principalmente, por se tratar de uma zoonose. Por menor que seja a eficácia das vacinas disponíveis, ações adicionais podem ser agregadas para aumentar a eficácia geral das estratégias de saúde animal e pública, como as ferramentas descritas no próximo item.
De qualquer forma, novas pesquisas são necessárias e algumas estão em andamento para a identificação de antígenos recombinantes que sejam mais promissores para prevenção e controle da leishmaniose, tanto humana quanto a canina.
Quais ferramentas nos restam?
Nenhuma medida disponível no momento tem a capacidade de controlar a doença na população de cães, mas existem opções que ajudam a reduzir os riscos de infecção, como o uso de coleiras impregnadas com produtos antiparasitários, como a deltametrina, que repelem os mosquitos e outros ectoparasitas, como pulgas e carrapatos. Além disso, é recomendável a instalação de telas mosquiteiras nos canis para manter os animais protegidos nos horários de maior atividade dos vetores e educação da população para a manutenção da limpeza de terrenos. Exigir dos órgãos públicos a limpeza de áreas verdes ou abandonadas também é dever de todo cidadão. A saúde começa com higiene e saneamento básico!
Outra ferramenta importante é o tratamento dos cães com diagnóstico confirmado por reduzir a carga de parasitas no sangue e, consequentemente, a chance de infecção dos mosquitos, além de reduzir os sinais da doença e dar maior qualidade de vida ao animal, se atendidas as devidas precauções. O único antiparasitário atualmente disponível para uso em cães é a miltefosina (Milteforan®), de uso oral, que foi registrada em 2018 pelo Mapa. A partir desse momento, a leishmaniose canina passou a ser uma doença tratável. Entretanto, destaca-se que o tratamento não é capaz de curar o animal, sendo os ciclos de medicação provavelmente necessários por toda a vida, pois não ocorre a completa eliminação da Leishmania do organismo do hospedeiro. O tratamento é fácil de ser realizado pelos tutores, mas requer um acompanhamento do médico veterinário para avaliação do quadro clínico e da transmissibilidade.
Enfim, o diagnóstico! Qual teste usar?
A melhor resposta é: depende! Segundo a Organização Mundial de Saúde Animal (WOAH, 2021), existem quatro situações com objetivos diagnósticos diferentes e oito métodos laboratoriais internacionalmente reconhecidos, sendo quatro sorológicos (realizados a partir de amostras de sangue) e quatro de detecção do agente (realizados a partir de amostras preferencialmente de tecido).
1. Para a comprovação de ausência de infecção numa população, como um plantel de criação ou cães de uma área geográfica, por exemplo, os métodos mais indicados são os seguintes testes sorológicos:
a. Imunofluorescência indireta (IFAT)
b. Ensaio imunoenzimático (ELISA)
2. Para ações de vigilância ativa (busca ativa por animais positivos pelos serviços veterinários) ou estudos de prevalência (saber qual o percentual aproximado de animais infectados na população), os mesmos testes sorológicos são os de eleição:
a. Imunofluorescência indireta (IFAT)
b. Ensaio imunoenzimático (ELISA)
3. Para garantir que um indivíduo sem sinais clínicos não está infectado antes de fazer uma movimentação (venda, adoção, viagens etc.), o mais indicado é a detecção do agente por:
a. Métodos moleculares (reação em cadeia da polimerase – PCR)
4. Para a confirmação de suspeitas clínicas (animais com sinais clínicos compatíveis com leishmaniose canina), são aceitos tanto os métodos de detecção do agente quanto os sorológicos.
Métodos de detecção do agente:
a. Exame citológico
b. Exame histológico
c. Cultura e isolamento
d. Métodos moleculares (PCR)
Métodos sorológicos:
e. Imunofluorescência indireta (IFAT)
f. Ensaio imunoenzimático (ELISA)
g. Teste de aglutinação direta
h. Teste rápido de imunocromatografia
É importante destacar que para a confirmação de suspeitas (item 4) todos os métodos reconhecidos possuem uma capacidade diagnóstica mediana, isto é, nenhum deles é considerado excelente por terem algumas limitações. Nesse contexto, as informações de histórico epidemiológico dos animais são ainda mais relevantes para qualquer tomada de decisão, tendo em vista que resultados falsos positivos ou falsos negativos podem ocorrer em uma fração considerável dos indivíduos suspeitos.
Conhecer o momento correto de aplicação de cada teste é essencial para aumentar as chances de detecção da infecção. Os métodos sorológicos, por exemplo, são os mais indicados nos estágios iniciais da doença, pois a soroconversão ocorre nos cinco primeiros meses de infecção. Os testes mais utilizados, nessa situação, são a IFAT ou o ELISA. O teste rápido de imunocromatografia pode ser facilmente realizado em clínicas ou ambulatórios veterinários, mas possuem uma eficiência diagnóstica inferior à IFAT e ao ELISA, ou seja, acaba ficando mais caro por indivíduo e é menos sensível, tendo maior chance de apresentar resultado falso negativo. Já o resultado positivo pode ser considerado mais confiável.
Nos casos subclínicos, ou seja, quando há baixa infestação parasitária e lesões sutis, apenas o isolamento in vitro e a PCR são capazes de detectar o agente. Entretanto, é possível que resultados positivos na PCR a partir de amostras de pele não necessariamente reflitam um quadro de infecção instalada, principalmente, em animais resistentes de áreas endêmicas. Da mesma maneira, amostras de medula óssea podem apresentar resultados positivos e em seguida resultarem negativas de acordo com a evolução da doença.
Sendo assim, o ideal é associar testes sorológicos com os de detecção do agente, adotando-se estratégias de testagem em paralelo ou em série de acordo com o quadro clínico-epidemiológico verificado e enquanto persistirem dúvidas.
Amostras necessárias para a execução de cada método
Deve-se dar preferência para amostras frescas, congeladas ou fixadas em álcool etílico a 95%.
Exame citológico
Punção aspirativa de lesões de pele, nódulos, linfonodos ou de medula óssea, sendo esta última a mais indicada. O procedimento pode ser incômodo.
Exame histológico
Biopsia de lesões de pele, principalmente, as com alterações granulomatosas. O procedimento pode ser incômodo, requer anestesia local e sutura ou outra forma de reparação da pele.
Cultura e isolamento
Punção aspirativa de linfonodos, medula óssea, lesões de pele, biopsias de pele e sangue (camada leucoplaquetária). Requer meios de cultura, estrutura e capacidade laboratorial.
Métodos moleculares (PCR convencional, PCR aninhada ou PCR em tempo real)
A punção aspirativa de medula óssea ou de linfonodos é a mais indicada, sendo possível também a análise em punção ou biopsia de pele, sangue (camada leucoplaquetária ou sangue periférico). Requer estrutura e capacidade laboratorial. Mais indicado para movimentação de animais sem sinais clínicos.
IFAT - Imunofluorescência indireta
Sangue. Fácil execução. Titulações a partir de 1/160 são indicativas de infecção estabelecida. Indicado para investigações epidemiológicas, além da confirmação de casos clínicos.
ELISA - Ensaio imunoenzimático
Sangue. Reações cruzadas com Babesia canis e Trypanossoma spp. podem ocorrer. Indicado para investigações epidemiológicas, além da confirmação de casos clínicos.
Teste de aglutinação direta
Sangue. Rápido e de fácil execução. Não requer estrutura laboratorial. Indicado para investigações epidemiológicas a campo.
Teste rápido de imunocromatografia
Sangue. Rápido e de fácil execução. Não requer estrutura laboratorial. Entretanto, é menos sensível que IFAT e ELISA e possui maior chance de resultado falso negativo. Não quantifica a titulação sorológica, mas pode ser útil para avaliar a resposta ao tratamento.
Como pode-se perceber, o diagnóstico da leishmaniose canina é complexo e requer primeiramente uma clara identificação do objetivo pretendido a partir do resultado a ser obtido. Em seguida, uma avaliação clínica completa e conhecimento do histórico epidemiológico dos animais e do local de origem, pelo médico veterinário, é decisivo para a melhor escolha e interpretação de um ou mais testes utilizados de acordo com cada situação e cada caso.
Gostou do conteúdo? Entre em contato para saber mais!
Imagem: Anoir Chafik / Unsplash
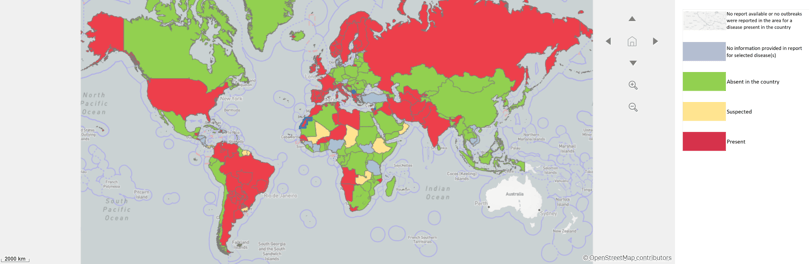
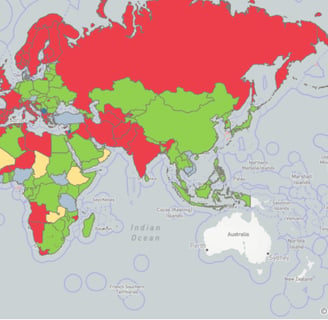
Mapa mundial de acordo com a situação epidemiológica da leishmaniose (WAHIS, 2023).


